Paradosso di Gibbs
Josiah Willard Gibbs
(1839 – 1903)
In termodinamica il paradosso di Gibbs coinvolge la natura discontinua dell’entropia configurazionale. Molti fisici ritengono la discontinuità dell’entropia contraria all’intuizione e al senso comune e pertanto vedono questa discontinuità come un paradosso.
Il primo ad occuparsene fu Josiah Willard Gibbs nel suo lavoro Sull’Equilibrio delle Sostanze Eterogenee. Sia dato un recipiente diviso a metà da un pistone mobile; da un lato del recipiente si trova un gas ideale A, e dall’altra parte un gas ideale B alla stessa temperatura e pressione. Quando la divisione viene rimossa, i due gas si mischiano e l’entropia del sistema cresce perché vi è maggior grado di incertezza nella posizione delle particelle. Si può dimostrare che l’aumento di entropia del miscuglio moltiplicata per la temperatura è uguale al lavoro necessario per ristabilire le condizioni iniziali: il gas A da una parte, il gas B dall’altra. Se si tratta dello stesso gas, non è necessario lavoro, ma se i gas sono differenti, anche per una differenza minuscola, il lavoro aumenta raggiungendo un valore elevato, e inoltre il valore è lo stesso di quello che si ha nel caso in cui la differenza tra i due gas è maggiore. L’entropia configurazionale di liquidi, solidi e soluzioni può essere calcolata in modo simile e il paradosso di Gibbs può essere applicato indifferentemente a liquidi, solidi e soluzioni in fase condensata come pure ai gas.
Quando il paradosso di Gibbs venne esposto, la correlazione dell’entropia configurazionale con la similitudine era molto controversa e vi erano tre opinioni molto differenti di valutare il valore dell’entropia come legato alla similitudine. La similitudine può continuamente cambiare:
similitudine �=0 se i componenti sono distinguibili;
similitudine �=1 se le parti non sono distinguibili.
L’entropia configurazionale, al contrario, non cambia continuamente.
Vi sono molte soluzioni proposte e tutte cadono in uno dei tre tipi di relazione tra entropia di configurazione-similitudine.
Una soluzione corrisponde alla Figura (a) e consiste nell’accettare la discontinuità come fatto, affermando che il senso comune e le obiezioni intuitive sono infondate. Questa è la soluzione data dallo stesso Gibbs, e riaffermata da E. T. Jaynes.
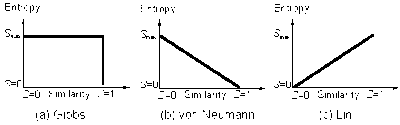
John von Neumann propose una soluzione alternativa al paradosso di Gibbs rimuovendo la discontinuità dell’entropia configurazionale: decresce in maniera continua con il crescere della proprietà di similitudine delle singole componenti (Figura b). Recentemente Shu-Kun Lin ha elaborato un’altra relazione (Figura c).
Discontinuità dell’entropia
Spiegazione classica della termodinamica
Lo stesso Gibbs propose una soluzione al problema che molti scienziati ritengono come la soluzione di Gibbs del paradosso di Gibbs. Il punto cruciale della sua soluzione è il fatto che sviluppando una teoria classica basata sull’idea che i due differenti tipi di gas sono indistinguibili, e che uno non presenta alcuna misurazione che riveli la differenza, allora la teoria non possiede contraddizioni interne. In altre parole, se si considerano due gas A e B e non si sa che sono differenti, allora assumerli identici non causa alcun problema teorico. Se anche si fa un esperimento con questi gas che dà risultati non corretti, si è certamente scoperto un metodo per rilevare la loro differenza.
Questa visione suggerisce che i concetti di stato termodinamico ed entropia sono piuttosto soggettivi. La crescita dell’entropia – come risultato di miscuglio – moltiplicata per la temperatura è uguale al minimo ammontare di lavoro necessario per ripristinare lo stato iniziale dei gas separati. Supponiamo che due gas differenti siano separati da una parete, ma che non sia possibile rilevare la differenza tra essi. Quando si rimuove la parete, il lavoro necessario a ristabilire la condizione iniziale è diverso da zero nel momento in cui siamo in grado di distinguere la differenza e non dipende dalla portata della differenza.
Il paradosso si risolve sostenendo che la discontinuità è reale e che ogni “senso comune” o obiezione “intuitiva” a esso sono infondate.
Spiegazione della meccanica statistica e della meccanica quantistica
Un gran numero di scienziati crede che questo paradosso sia risolto dalla meccanica statistica (attribuita anche a Gibbs) o dalla meccanica quantistica, ponendo che, se i due gas sono composti da particelle indistinguibili, essi obbediscono a differenti statistiche rispetto al caso in cui fossero distinguibili. Dal momento che la distinzione tra le particelle è discontinua, si ha l’entropia configurazionale. L’equazione risultante per l’entropia di un classico gas ideale è estensiva, ed è nota come l’equazione di Sackur-Tetrode.
Continuità dell’entropia
Mentre molti scienziati si ritrovavano nella formulazione di discontinuità dell’entropia mostrata nella Figura (a) e nelle spiegazioni classiche o facenti uso della meccanica quantistica in termodinamica o in meccanica statistica, altri ritenevano che il paradosso di Gibbs fosse un paradosso reale da risolversi mostrando la continuità dell’entropia.
Risoluzione del paradosso di Gibbs per la meccanica quantistica
John von Neumann
(1903 – 1957) )
Nel suo libro, Mathematical Foundations of Quantum Mechanics, John von Neumann fornì, per la prima volta, una risoluzione del paradosso di Gibbs rimuovendo la discontinuità dell’entropia configurazionale: essa decresce continuamente con il crescere della similitudine delle componenti individuali (Si veda la Figura (b)).
A pagina 370 della versione inglese del testo, si legge che ” … Questo chiarisce un vecchio paradosso della forma classica della termodinamica, cioè la scomoda discontinuità nell’operazione con pareti semi-peremeabili… Ora abbiamo una transizione continua.”
Furono pochi gli scienziati che accettarono questa soluzione, altri non sono ancora convinti.
Risoluzione del paradosso mediante la teoria dell’informazione
Un’altra relazione di continuità entropica fu proposta da Shu-Kun Lin, basandosi su una considerazione di teoria dell’informazione, come mostrato nella Figura (c). Un calorimetro viene impiegato per determinare l’entropia configurazionale al fine di verificare la proposizione del paradosso di Gibbs o per risolvere il paradosso stesso. Sfortunatamente è noto che nessuno dei processi di miscuglio tipici hanno una quantità rilevabile di calore e lavoro trasferiti, nonostante sia misurabile una grande quantità di calore, fino al valore calcolato come �Δ� (dove � è la temperatura e � i l’entropia termodinamica), e nonostante sia osservabile un elevato valore di lavoro fino a Δ� (dove � è l’energia libera di Gibbs). È necessario ammettere il fatto che la differenza di entropia configurazionale dei gas ideali è sempre zero, sia che i gas siano differenti o identici; tale conclusione può essere considerata come una risoluzione sperimentale del paradosso di Gibbs per i gas ideali. Ciò suggerisce che l’entropia configurazionale non ha nulla a che vedere con l’energia (calore �Δ� o lavoro Δ� ). Un processo di miscuglio è un processo di perdita di informazioni che può essere discusso pertinentemente solo nell’ambito della teoria dell’informazione e l’entropia configurazionale è un’entropia di informazione. Per entropia di informazione (chiamata anche entropia della teoria dell’informazione, o entropia di Shannon), si intende che si tratta di una funzione logaritmica adimensionale �=ln� nella teoria dell’informazione. Non si tratta di una funzione della temperatura � e non è necessariamente legata all’energia. In luogo del calorimetro, è possibile utilizzare, per valutare la perdita di informazione durante il miscuglio, sensori chimici o biosensori. Mescolare 1 mole di gas A e 1 mole di un gas diverso B provoca un aumento di al più 2 bits di entropia di informazione se le due parti del contenitore sono usate per registrare 2 bits di informazioni.
Per le fasi condensate, invece della parola “miscuglio” si può usare la parola “mescolanza” per i processi che combinano varie parti di sostanza originariamente in contenitori differenti. Quindi, è sempre un processo di mescolanza, sia qualora le sostanze siano molto diverse, o molto simili o persino le stesse. Il modo convenzionale per calcolare l’entropia configurazionale predice che il processo di miscuglio (o mescolanza) di sostanze differenti (distinguibili) è più spontaneo che il processo medesimo tra sostanze uguali (indistinguibili). Tuttavia, questo contraddice l’esperienza, che mostra come il processo di mescolanza della stessa sostanza (o di sostanze indistinguibili) è il più spontaneo; esempi immediati sono la mescolanza spontanea di gocce d’olio in acqua e la cristallizzazione spontanea in cui le celle di lattice indistinguibili si assemblano tra loro. Sostanze più simili sono miscibili più spontaneamente: metanolo ed etanolo sono miscibili perché sono molto simili. Senza eccezioni, tutte le osservazioni sperimentali supportano la relazione entropia-similitudine espressa nella Figura (c). Ne deriva che la relazione entropia-similitudine data da Gibbs nella Figura (a) è opinabile. Una conclusione significativa è che – almeno allo stato solido – l’entropia configurazionale ha un valore negativo per i solidi distinguibili: mischiare sostanze diverse diminuisce l’entropia di informazione, e mescolare molecole indistinguibili (da un gran numero di contenitori) per formare una fase di sostanza pura provoca un forte aumento dell’entropia di informazione. Cominciando da una mistura binaria di solidi, mescolando 1 mole di molecole del tipo A per formare una fase e mescolare 1 mole di molecole di tipo B per formare un’altra fase porta ad un aumento dell’entropia di informazione quantificabile in 2⋅6.022⋅1023=12.044⋅1023 bits =1.506⋅1023 bytes, dove 6.022⋅1023 è il numero di Avogadro; e vi sono al massimo solo 2 bits di informazione persa.
da Wiki


 Made in Italy/Rome | Copyright © 2011-2025
Made in Italy/Rome | Copyright © 2011-2025